الورم النِقوي المتعدد

يُعد الورم النِقوي المتعدد سرطانًا يصيب النخاع العظمي، حيث يعاني المُصاب إنتاجًا خارجًا عن السيطرة لخلايا بلازمية خبيثة في الجسم. والخلايا البلازمية لدى الأصحاء هي خلايا الدم البيضاء التي تُنتج أجسامًا مضادة لمكافحة العدوى في الوضع الطبيعي. تتراكم خلايا الورم النِقوي في النخاع العظمي مانعة إياه من إنتاج خلايا دم سليمة: خلايا الدم الحمراء الناقلة للأكسجين، وخلايا الدم البيضاء المقاومة للعدوى، والصفائح الدموية اللازمة لتخثر الدم. بالإضافة إلى ذلك، تُنتج خلايا الورم النِّقَوِي أجسامًا مضادة غير وظيفية (تُسمى ببروتينات ’M‘) بمعدل مرتفع والتي يمكنها مع خلايا الورم النِّقَوِي أن تتراكم في مناطق عديدة في الجسم (ومن ثم ينتج الورم النِّقَوِي ’المتعدد‘). يؤدي تراكمهما إلى إلحاق تلف بأعضاء وأنسجة أساسية، منها الكلى (حيث تتسبب في الفشل الكلوي) والعظام (حيث تسبب سهولة حدوث الكسور بالإضافة إلى ارتفاع مستويات الكالسيوم في الجسم).
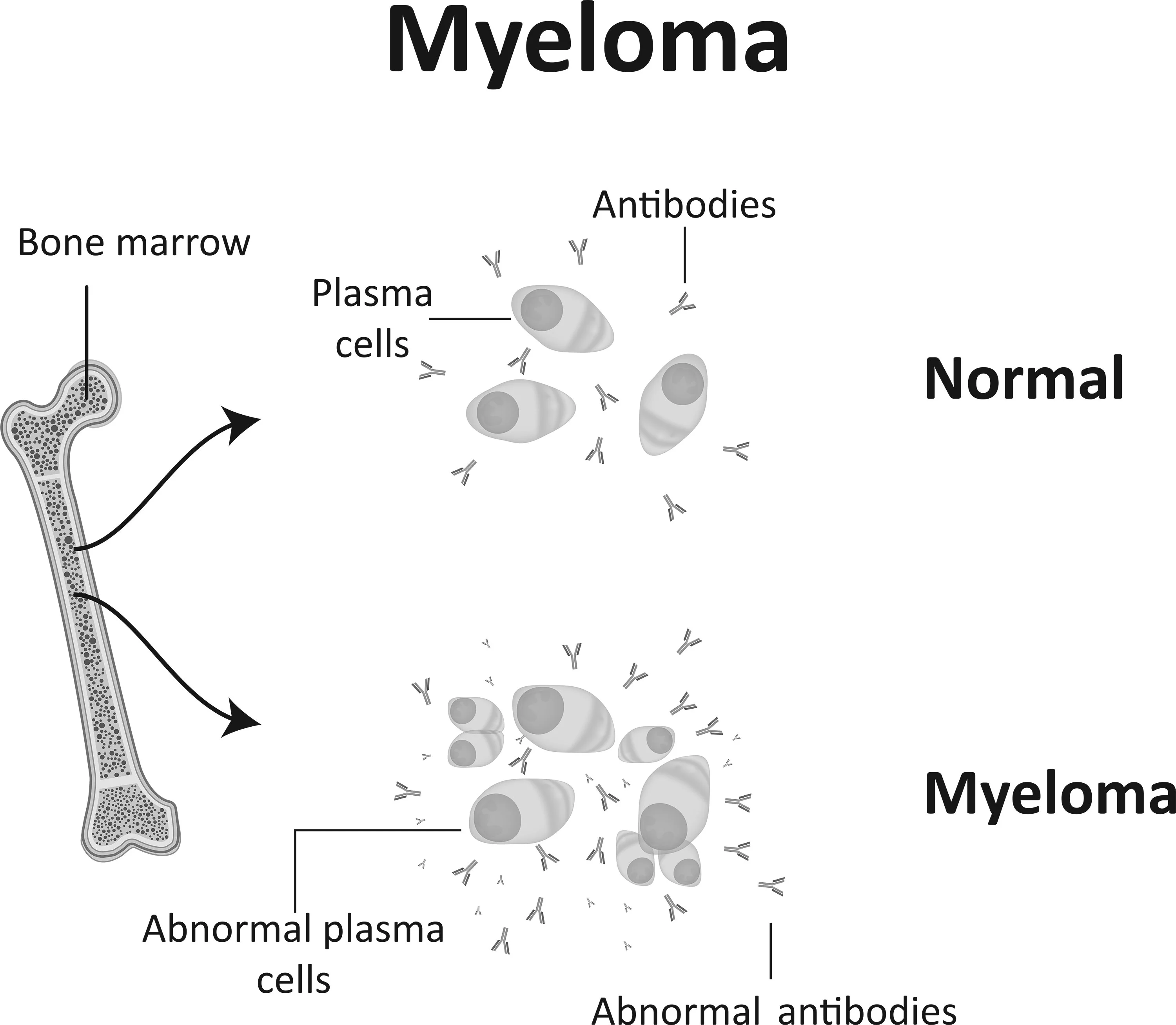
إن السبب في الورم النِّقَوِي المتعدد مجهول. ولقد جرى تحديد عوامل الخطورة التالية وراء الإصابة بالورم النِّقَوِي المتعدد:
- العمر – يزداد خطر الإصابة بالورم النِّقَوِي المتعدد مع تقدم العمر. كما أنه أكثر شيوعًا بين من تخطوا عمر 65 عامًا.
- الجنس – يزداد معدل وقوع الورم النِّقَوِي المتعدد بين الرجال أكثر منه بين النساء.
- العرق – يعاني الأمريكيون من أصول إفريقية ارتفاع معدل خطر إصابتهم بالورم النِّقَوِي المتعدد عن غيرهم.
- التاريخ الشخصي – قد يكون الأشخاص الذين عانوا سابقًا مرضًا في الخلايا البلازمية -اعتلال غامائي أحادي النسيلة غير مُحدد القيمة (MGUS)- أكثر عرضة لتطوير الورم النِّقَوِي المتعدد. يتسم الاعتلال الغامائي أحادي النسيلة غير مُحدد القيمة بوجود بروتينات M في الجسم.
- التاريخ العائلي – يرتفع خطر الإصابة بالورم النِّقَوِي المتعدد لدى من كان أحد أقاربهم من الدرجة الأولى (مثل الأخ أو أحد الوالدين) مصابًا بالمرض.
- السمنة – قد يعاني زائدو الوزن أو المصابون بالسمنة خطرًا أكبر للإصابة بالورم النِّقَوِي المتعدد.
قد لا يعاني المرضى في المراحل المبكرة أي أعراض خاصة بالورم النِّقَوِي المتعدد. كما قد تختلف الأعراض من شخص لآخر. الأعراض الشائعة هي:
- الإرهاق
- شحوب الجلد
- عُسر التنفس
- الضعف
- الدوار
- عطش متزايد
- فقدان الشهية
- الإمساك
- التشوش الذهني
- تلف الكلى
- تورم الأطراف السفلية (نتيجة مشكلات الكلى)
- التبول المتكرر
- ألم في العظام، وعظام ضعيفة أو مكسورة
- ألم في الظهر أو البطن
- حمى
- حالات العدوى المتكررة
>هناك اختبارات متنوعة مُستخدَمة في فحص الورم النِّقَوِي المتعدد وتشخيصه بما في ذلك فحوص الدم، والبول، وخزعة النخاع العظمي، والتصوير الإشعاعي (مثل الأشعة السينية، والفحص بالرنين المغناطيسي (MRI)، والتصوير المقطعي المحوسب بالإصدار البوزيتروني (PET-CT)). في الفحص البدني، سيتحقق الطبيب بحثًا عن علامات المرض مثل التورم أو أعراض أخرى غير اعتيادية. تعداد الدم الكلي هو اختبار الدم الذي يتضمن إرسال عينة من الدم إلى المعمل للتحقق منها. يتم فحص عينة الدم لتحرّي عدد خلايا الدم الحمراء والبيضاء والصفائح الدموية. كما سيكون لزامًا إجراء المزيد من فحوص الدم للتحقق من مستويات بروتين M والأجسام المضادة الأخرى غير الطبيعية فيه.
وينبغي أيضًا إجراء فحوص البول في وقت تشخيص الورم النِّقَوِي المتعدد. كما أن هذه الفحوصات تتحقق من وجود البروتين غير الطبيعي في البول بالإضافة إلى كميته فيه. ينطوي إجراء خزعة النخاع العظمي على أخذ عينة من النخاع العظمي، وعادة ما تكون من عظم الورك. يتم ذلك تحت تأثير التخدير الموضعي ويستغرق من 15إلى 20 دقيقة. كما ستُرسَل العينة إلى المعمل للتحقق منها، وذلك لفحصها للوقوف على عدد خلايا الورم النِّقَوِي، والنمط النووي، وفحوص التهجين في موقع مُفَلْوَر (FISH) (البحث عن تغيرات غير طبيعية في كروموسوم الورم النِقَوي).
يفيد تصنيف المراحل أو الوقوف على مرحلة السرطان أمرًا في اتخاذ قرار حيال الخيارات العلاجية. هناك نوعان من الأنظمة المُستخدمة لتصنيف مراحل الورم النِّقَوِي المتعدد: نظام تصنيف المراحل العالمي المُنقح (RISS) ونظام ديوري سالمون لتصنيف المراحل.
يعتمد نظام تصنيف المراحل العالمي المُنقح (RISS) شائع الاستخدام على أربعة عوامل رئيسية:
- كمية الألبومين في الدم – الألبومين هو بروتين يُنتجه الكبد ويلعب دورًا مهمًا في مقاومة العدوى وفي بناء أنسجة العضلات وإصلاحها.
- كمية بِيتا 2-المِكْرُوغلُوبولين في الدم – بِيتا 2-المِكْرُوغلُوبولين هو بروتين تُنتجه خلايا الورم النِّقَوِي. يشير وجود مستويات مرتفعة من هذا البروتين إلى مرحلة متقدمة من الورم النِّقَوِي المتعدد.
- كمية نازِعَة هيدروجينِ اللَّاكتات (LDH) في الدم – نازِعَةُ هيدروجينِ اللَّاكتات (LDH) هو إنزيم موجود في الأنسجة. يشير وجود مستويات مرتفعة من هذا الإنزيم إلى احتمالية وجود تلف في الأنسجة.
- تشوهات جينية خاصة بالسرطان (الوراثيات الخلوية) – لقد تم الربط بين وجود تغيرات كروموسومية محددة، مثل فقدان جزء من الكروموزوم 17، وتوقع سير المرض على نحو سيء.
استنادًا إلى العوامل المذكورة أعلاه، يُصنف الورم النِّقَوِي المتعدد إلى ثلاث مراحل:
- المرحلة رقم 1 – يقل بروتين بِيتا 2-المِكْرُوغلُوبولين في مصل الدم عن 3.5 ملجم/لتر؛ ويكون مستوى الألبومين 3.5 جم/ديسيلتر أو أكثر؛ وفي هذه الحالة تُعد الوراثيات الخلوية ""غير مرتفعة الخطورة""؛ ومستوى نازِعة الهِدْرُجِين اللَّاكْتاتِيَّ (LDH) طبيعي.
- المرحلة رقم 2 – يتراوح بروتين بِيتا 2-المِكْرُوغلُوبولين في مصل الدم بين 3.5 ملجم/لتر و 5.5 ملجم/لتر؛ أو يقل مستوى الألبومين عن 3.5 جم/ديسيلتر.
- المرحلة رقم 3 – Sيقل بروتين بيتا 2-المِكْرُوغلُوبولين في مصل الدم 5.5 ملجم/لتر أو أكثر، وتعتبر الوراثيات الخلوية ""مرتفعة الخطورة""، ويكون مستوى نازِعة الهِدْرُجِين اللَّاكْتاتِيَّ (LDH) مرتفع.
تم تقديم نظام ديوري سالمون للتصنيف في عام 1975 وجرى تحديثه في عام 2006. ولقد أصبح أقل استخدامًا في تصنيف الورم النِّقَوِي المتعدد نظرًا لعدم احتسابه التغيرات الجينية (والكروموسومية) والتي تُشكل أهم عوامل توقع سير المرض في حالة الورم النِّقَوِي.
لن يعاني غالبية الأشخاص في مراحل إصابتهم المبكرة بالورم النِّقَوِي المتعدد أي أعراض (وهذا أمر معروف بالورم النِّقَوِي المتعدد الخامد/عديم الأعراض) ولن يكونوا في حاجة إلى العلاج. وسيُراقَب المرضى بفاعلية من خلال خضوعهم إلى فحوصات دورية واختبارات دم وبول. وعادة ما لا يبدأ العلاج إلا عندما يصبح المرض أكثر تقدمًا. ونعرض فيما يلي بعض الخيارات العلاجية القياسية. عامة، يُوصى بإعطاء مجموعات مكونة من 2-3 أدوية لعلاج الورم النِّقَوِي.
العلاج الموجّه
تستخدم الأدوية أو غيرها من المواد في العلاج الموجّه لتدمير الخلايا السرطانية أو للحد من تكاثرها، دون مساس بالخلايا السليمة. بالنسبة للورم النِّقَوِي المتعدد، قد تستخدم الأدوية الموجهة والتي تعمل على منع خلايا الورم النِّقَوِي من الانقسام إلى بروتينات، أو تلك التي ترتبط بخلايا الورم النِّقَوِي متسببة بذلك في موت خلاياه. ومن أكثر الأدوية استخدامًا مثبطات الجسيمات البروتينية (البروتيزومات) والتي يتم تناولها عادة مع أدوية التعديل المناعي.
المُعدِلات المناعية
هي عبارة عن أقراص تتمتع بنشاط مرتفع مع الورم النِّقَوِي وعادة ما تُستخدم مصاحبة لمثبطات الجسيمات البروتينية والستيرويدات. كما تستخدم المُعدِلات المناعية أيضًا عقب إتمام العلاج بمثبطات الجسيمات البروتينية كسبيل للسيطرة على نمو/انتشار خلايا الورم النِّقَوِي أو ضبطه.
العلاج البيولوجي
تعزز أدوية العلاج البيولوجي من قدرة جهاز الجسم المناعي على تحديد خلايا الورم النِّقَوِي وإتلافها. وتؤخذ هذه الأدوية عبر الوريد (الحقن الوريدي).
العلاج الكيميائي
يستخدم العلاج الكيميائي أدوية لتدمير الخلايا السرطانية أو إيقاف انقسامها. ويمكن إعطاء الأدوية عن طريق الوريد (عبر وريد في اليد أو الذراع) أو في شكل أقراص.
الستيرويدات القشرية
في علاج الورم النِّقَوِي. وعادة ما تُستخدم مصاحبة لأدوية أخرى (كما ذُكر أعلاه). قد تُعطى الستيرويدات القشرية وريديًا أو على هيئة أقراص.
العلاج الإشعاعي
في العلاج الإشعاعي، تُستخدم الأشعة السينية لتحطيم خلايا الورم النِّقَوِي في الجسم. يتم توفير العلاج الإشعاعي الخارجي من قبل آلة خارج الجسم. قد يُستخدم العلاج الإشعاعي لتقليل خلايا الورم النِّقَوِي في منطقة محددة بسرعة؛ مثلما يحدث عندما تتراكم الخلايا البلازمية غير الطبيعية لتشكل ورمًا.
العلاج الكيميائي مرتفع الجرعة مع زراعة الخلايا الجذعية
ينبغي دومًا تقييم المرضى الأصغر سنًا (عادة الأقل من 65 عامًا) المصابين بالورم النِّقَوِي للوقوف على مدى استعدادهم للخضوع إلى زراعة خلايا جذعية ذاتية. تُشير زراعة الخلايا الجذعية الذاتية إلى أخذ الخلايا الجذعية من جسم المريض نفسه. وتمثل زراعة الخلايا الجذعية الذاتية نموذجًا علاجيًا فائق الأهمية بسبب قدرته على التحكم في مرض الورم النِّقَوِي لفترة أطول. عادة ما تُجرى هذه الزراعة عقب مرور فترة من العلاج بالأدوية (كما هو مُدرج أعلاه)، وبعد أن يكون قد تم القضاء على أغلب خلايا الورم النقوي. والفكرة من الإجراء هي إعطاء جرعة مرتفعة من العلاج الكيميائي لقتل أي خلايا ورم نِّقَوِي متبقية، ثم استخدام خلايا جذعية مأخوذة مسبقًا لإنقاذ نخاع المريض العظمي من سُميّة العلاج الكيميائي مرتفع الجرعة.
لا يمكن تجنب معظم عوامل الخطورة المؤدية للإصابة بالورم النِّقَوِي المتعدد، لذا لا توجد طريقة معروفة للوقاية من هذا المرض.

CanHOPE خدمة غير ربحية لتقديم المشورة والدعم فيما يتعلق با يقدمها مركز سرطان باركواي (Parkway Cancer Centre)، سنغافورة. تتكون CanHOPE من فريق دعم يتسم بالخبرة والمعرفة والرعاية يتمتعبالقدرة على الوصول إلى معلومات شاملة حول مجموعة كبيرة من الموضوعات المتعلقةبالتوعية والإرشادات الخاصة بعلاج السرطان.
توفر CanHOPE:
- معلومات حديثة حول السرطان للمرضى والتي تشتمل على أساليبالوقاية من السرطان، والأعراض، والمخاطر، وفحوص التصوير بالأشعة، والتشخيص،والعلاجات الحالية، والأبحاث المتاحة.
- الإحالات إلى الخدمات المرتبطة بالسرطان مثل مرافق الفحص بالأشعةوالاستقصاء، ومراكز العلاج، والاستشارةالتخصصية المناسبة.
- المشورة حول السرطان والنصح بإستراتيجيات لإدارة آثارالعلاج الجانبية، والتأقلم مع السرطان، والحمية الغذائية والتغذية.
- الدعم الوجداني والنفسي للمصابين بالسرطانوأولئك الذين يرعونهم.
- أنشطة مجموعات الدعم، مع التركيز على المعرفة، والمهارات،والأنشطة الداعمة لتثقيف المرضى وخلق وعيلديهم والقائمين على الرعاية.
- المصادر لخدمات إعادة التأهيل والخدمات الداعمة
- الرعاية التلطيفية لتحسين نوعية حياة المرضىالمصابين بسرطان متقدم.
سيعمل فريق CanHOPE على الأخذ بأيدي المرضى مقدمًا لهمالدعم والرعاية المخصصة حيث إنهم يجتهدون لمشاركة بصيص أملمع كل من يقابلونه.
